潤澤儀器商城 - 2020-05-14
文章譯自浙江大學蔡圣老師團隊發表于Journal of Pharmaceutical Analysis(JPA)期刊的一篇綜述。原標題為:《Recent advances and perspectives of nucleic acid detection for coronavirus》
新型冠狀病毒(SARS-CoV-2)引起的肺炎暴發對全球公共衛生構成了巨大威脅。因此建立快速的標準診斷測試以檢測傳染病(COVID-19),防止繼發性傳播尤為重要。聚合酶鏈反應(PCR)被視為具有高靈敏度和特異性的病毒和細菌感染分子診斷的金標準。等溫核酸擴增因為其在恒溫條件下無需熱循環儀即可快速操作的基本優勢,被認為是一種非常有前途的候選方法。這篇綜述總結了目前可用于冠狀病毒核酸的檢測方法,有助于研究人員和臨床醫生開發更好的技術,以及時有效地檢測冠狀病毒感染。
1 基于PCR的方法
PCR是一種酶學方法,可通過分離包含基因片段的兩條DNA鏈,用引物標記其位置,并使用DNA聚合酶在每個片段旁邊組裝一個拷貝并連續復制這些拷貝來產生基因的多個拷貝,該技術被廣泛用于擴增微量生物材料。由于它的高靈敏度和高序列特異性,基于PCR的方法已成為用于檢測冠狀病毒常規和可靠的技術。通常操作是,通過逆轉錄將冠狀病毒RNA轉移到cDNA中,然后,進行PCR擴增,最后通過特定的檢測方法或儀器檢測PCR產物。在這些中,凝膠可視化和測序是PCR技術之后用于檢測冠狀病毒方法,然而,由于其過程耗時且成本較高,這些方法在臨床樣品中并不常用。
實時逆轉錄PCR(RT-PCR)技術目前被冠狀病毒檢測所青睞,因為它具有特異性強,簡便進行定量分析的優勢。此外,在早期,實時RT-PCR比常規RT-PCR測定法能夠診斷出更多感染者。因此,實時RT-PCR測定法仍然是一個主要的方法被應用于檢測各種冠狀病毒的檢測。
盡管RT-PCR已經在本次戰“疫”中大顯身手,但科學界依然投入大量精力來改進實時RT-PCR技術。因為RT-PCR方法容易受到污染,并且樣品處理和PCR后數據分析耗時。因此,van Elden等描述了基于TaqMan的實時RT-PCR,可以在常規診斷設置中輕松實現HCoV的檢測。此外,為了進一步提高靈敏度,Yip等人使用2個TaqMan探針代替1個探針設計了SARS-CoV的實時定量RT-PCR分析。使用雙TaqMan探針進行定量的這種簡單修飾方法在需要超敏性的領域具有廣泛的應用,SARS-CoV檢測限為每個反應1個拷貝RNA。
在臨床檢測中,缺乏安全和穩定的外部陽性對照(EPC)可能成為冠狀病毒診斷中的嚴重問題,該問題已引起了廣泛關注。Yu等開發了一種實時RT-PCR分析,其中裝甲RNA被用作EPC來檢測SARS-CoV,檢測極限為10拷貝/μL。同時,冠狀病毒的快速突變性質凸顯了對準確檢測遺傳多樣性冠狀病毒的需求。因此,為了提高精確檢測冠狀病毒的能力并降低由基因組序列變異引起的假陰性結果的風險,研究人員建立了多重實時RT-PCR方法,對冠狀病毒的多靶點檢測具有良好的敏感性。Hadjinicolaou等使用耐錯配的分子信標開發了實時RT-PCR測定法,以區分致病菌株和非致病菌株。該測定法包含四個信標,除了內部陽性對照外,還靶向四個基因。它已使用臨床樣品進行了驗證,該樣品具有目標檢測能力和特異性,每個反應的檢測極限為5個拷貝。
2 基于核酸等溫擴增的方法
2.1 基于常規的LAMP方法
LAMP是高效的新型等溫核酸擴增方法。它通常用于DNA和RNA的擴增,由于其指數擴增特性,且分別由4種不同的引物同時鑒定的6個不同的靶序列而顯示出很高的靈敏度和高特異性。另一方面,LAMP技術測定快速且不需要昂貴的試劑或儀器,因此,LAMP檢測的應用可能有助于降低檢測冠狀病毒的成本。目前,很多企業已經開發了基于LAMP的冠狀病毒檢測方法并將其應用于臨床診斷。
凝膠電泳通常用于分析擴增產物以進行終點檢測。潘等人報告了一種用于SARS診斷的簡單LAMP檢測方法,并證明了使用該技術檢測SARS-CoV的可行性。選擇SARS-CoV的ORF1b區域用于SARS診斷,并在6個引物的存在下通過LAMP反應進行擴增,然后通過凝膠電泳對擴增產物進行分析。LAMP分析中SARS-CoV的檢測率和靈敏度與常規基于PCR的方法相似。Pyrc等成功地將LAMP用于瓊脂糖凝膠電泳檢測HCoV-NL63,在細胞培養物和臨床標本中具有良好的靈敏度和特異性。值得注意的是,檢測極限是每個反應1個RNA拷貝。可以檢測到焦磷酸鎂或熒光染料的沉淀。通過監測焦磷酸鹽或熒光的濁度,可以使該方法實時進行,從而有效地解決了終點檢測的局限性。
Shirato等人以這種方式開發了一種有用的RT-LAMP測定法,用于診斷和監測人類MERS-CoV的流行病學。該技術能夠檢測到3.4份MERS-CoV RNA,并且具有高度特異性,與其他呼吸道病毒無交叉反應。Thai等開發了一種單步單管加速實時定量RT-LAMP測定法,該測定法通過在光度計中實時測量濁度進行監控,以早期和快速診斷SARS-CoV。在臨床樣品中,發現該檢測方法的靈敏度比常規RT-PCR高100倍,檢出限為0.01個噬菌斑形成單位(PFU)。
2.2 基于特定序列的LAMP方法
然而,如果這些方法依賴于非特異性信號轉導方案,例如熒光染料插入任何雙鏈DNA擴增子中,或者由于聚合過程中焦磷酸鹽的釋放而導致溶液渾濁,則不能排除由引物二聚體或非引物反應產生的意外信號的可能性。一種用于監視LAMP和其他等溫擴增反應的序列特定且可靠的方法,可以輕松地將真實信號與非特異性噪聲區分開來,解決此問題。
Shirato等通過使用淬滅探針(QProbe)監測信號改進了RT-LAMP測定,在檢測MERS-CoV方面與標準實時RT-PCR測定具有相同的性能。此外,黃等建立了一種將RT-LAMP和垂直流可視化條帶(RT-LAMP-VF)結合使用檢測MERS-CoV的核酸可視化技術。如圖1A 所示,等溫擴增中涉及的兩個環引物(LF和LB)分別用異硫氰酸熒光素(FITC)和生物素標記。擴增后,用生物素標記的擴增子可以結合與鏈霉親和素綴合的膠體金顆粒,形成復合物,隨后被包被在條帶文本行上的抗FITC抗體捕獲(圖1 B),從而呈現出肉眼可見的彩色線。在這種情況下,MERS-CoV RNA的檢出限為10拷貝/μL。
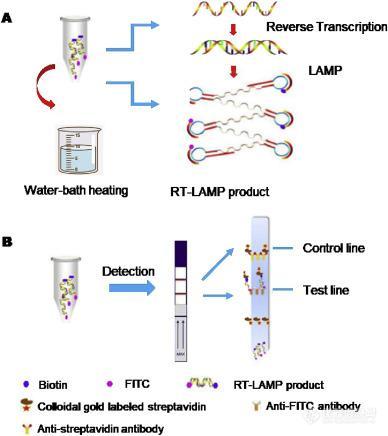
圖1. RT-LAMP-VF分析的示意圖。(A)用于RT-LAMP的擴增反應和(B)在可視化條上檢測。
埃靈頓小組的科學家做了很多工作,既可以提高LAMP檢測的特異性,又可以使讀數更簡單、更可靠。他們用稱為單步鏈置換(OSD)的介導鏈交換反應代替了通常用于實時熒光監測的嵌入染料,并將其用于LAMP擴增子的實時序列特異性驗證。所得檢測結果可在30-50分鐘內檢測出感染細胞培養上清液中的0.02-0.2 PFU(5-50 PFU / mL)的MERS-CoV,并且不會與常見的人類呼吸道病原體發生交叉反應還開發了其他鏈交換信號轉導,以使LAMP反應易于使用。如圖2所示,Du等通過將LAMP與熱穩定的轉化酶結合,可以直接將MERS冠狀病毒模板轉導為葡萄糖信號,通過商業血糖儀輕松讀取信號,可檢測20–100拷貝/μL。人絨毛膜促性腺激素(hCG)也被用作信號進行分析。hCG與DNA寡核苷酸位點特異性結合,從而在基于LAMP的病毒測定中允許通過鏈交換將信號轉導到hCG的捕獲(信號關閉)和釋放(信號打開)中。當人血清和唾液中僅有20拷貝病毒模板時,通過該方法也能準確檢測到。
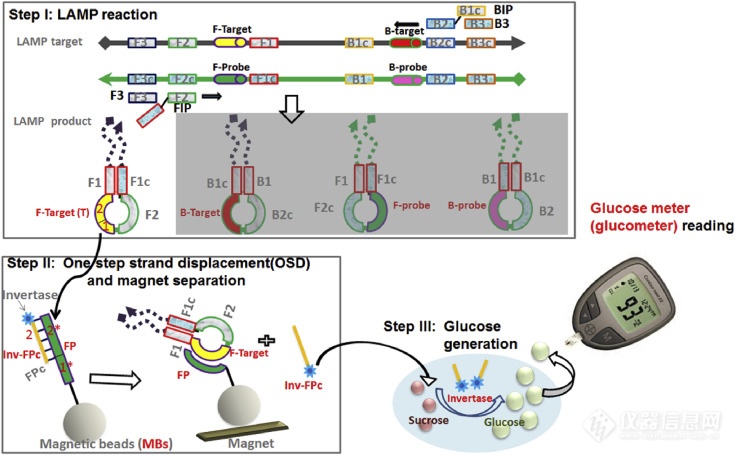
圖2 使等溫擴增適應血糖儀的方案。
同時,LAMP在65°C左右顯示最佳性能,這限制了其應用。蔡等開發了一種LAMP版本,該版本使用了硫代磷酸酯化引物(PS-LAMP),能夠在生長輔酶的末端更有效地形成和延伸發夾,從而在較低的溫度下工作。研究表明,在40°C下用PS-LAMP檢測擴增子的靈敏度和選擇性與65°C下的常規LAMP反應相當。
2.3 基于滾環擴增放大的方法
滾環擴增(RCA)在核酸檢測中已經獲得了相當大的關注。在等溫條件下,RCA能夠在90分鐘內將每個圓的信號放大109倍。有學者在液相和固相中都建立了通過RCA檢測SARS-CoV的有效方法,并在少量臨床呼吸道標本上提供了初步結果。RCA的主要優點是,它可以在恒溫條件下用最少的試劑進行操作,并且避免了假陽性結果的產生,而這在基于PCR的測定中經常遇到。
3 基于微陣列的方法
微陣列法是一種快速且高通量的檢測方法。在這種方法中,冠狀病毒RNA將首先通過逆轉錄產生用特定探針標記的cDNA。然后將這些標記的cDNA加載到每個孔中,并與固定在微陣列上的固相寡核苷酸雜交,然后進行一系列洗滌步驟以去除游離DNA。最后,可以通過檢測特定探針來檢測冠狀病毒RNA。由于其快速、高通量的優越性,微陣列分析已廣泛用于冠狀病毒的檢測。
Shi等根據TOR2的序列設計了一個60 mer的寡核苷酸微陣列,并將其成功地用于臨床樣品中SARS冠狀病毒的檢測。但是,考慮到SARS-CoV的快速突變,Guo等開發了一種微陣列,可在樣本檢測中以100%的準確度檢測SARS-CoV的尖峰(S)基因中的24個單核苷酸多態性(SNP)突變。Luna等設計了一種無熒光的低成本,低密度寡核苷酸陣列,用于檢測整個冠狀病毒屬,其靈敏度與各個實時RT-PCR的靈敏度相同,Hardick等(2002)評估了一種基于微陣列芯片的新型,便攜式和近POC診斷平臺,即移動分析平臺(MAP),它在識別病毒和可接受的檢測限方面具有良好的性能。
4 新開發的方法
相關酶的Cas13 RNA靶向CRISPR最近已適于核酸[快速和便攜式傳感。Zhang的研究小組證明,Cas13可以被編程為靶向并破壞多種哺乳動物單鏈RNA病毒的基因組(圖3)。他們開發了一個名為SHERLOCK(特定的高靈敏度酶報告分子解鎖)的平臺,該平臺將等溫預擴增與Cas13結合使用,以檢測RNA或DNA的單分子。它可以檢測登革熱或Zika病毒單鏈RNA以及患者液體活檢樣品中的突變。網站(https://broad.io/sherlockprotocol)上報道了他們最近關于COVID-19的協議,題為“使用CRISPR診斷程序檢測COVID-19的協議”,該協議可能為有興趣進一步研究的研究人員提供一些參考點該診斷系統突出了其作為核酸的可復用,便攜式,快速和定量檢測平臺的潛力。
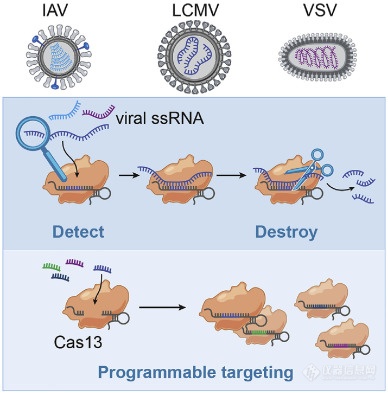
圖3 使用Cas13檢測RNA病毒的方案。
總結與展望
當前,COVID-19的診斷主要依賴于冠狀病毒RNA的檢測。選擇適當的檢測方法非常重要。但是,上述每種方法都有其獨特的優點和不可避免的缺點。PCR以高靈敏度和特異性廣泛用于病毒鑒定,但其分析需要各種專業設備和受過專業培訓的分析人員,而這只能由完善的實驗室來完成。LAMP是一種超靈敏的核酸擴增方法,通常可以在大約一個小時內檢測少量的DNA或RNA模板,但是高溫的要求仍然限制了其適用性。至于微陣列,高成本不可避免地限制了它在冠狀病毒檢測中的進一步應用。
迄今為止,科學家們已經做出了很大的努力來改善冠狀病毒的檢測,并且已經開發了各種改進的或新的方法。在實際應用中,通常將幾種方法結合起來,以盡量避免使用單一方法的弊端。簡而言之,隨著新技術和方法的飛速發展,我們相信未來將開發出更加出色和高效的檢測方法,這將為科學家/臨床醫生提供更多選擇。同時,只有根據特定目的平衡各種檢測方法的優缺點,才能獲得最經濟,最優化的選擇。
作者蔡圣:現任浙江大學藥學院副教授,碩士生導師。主要從事藥物分析新方法新技術研究,包括功能納米材料、核酸適配體技術在蛋白及藥物檢測中的應用;核酸擴增方法在藥物和藥物效應分子檢測和成像中的應用。
關于JPA:JPA于2011年創刊,是一本藥物分析研究領域的英文專業期刊,由教育部主管、西安交通大學主辦,與Elsevier合作出版,西安交通大學藥物分析研究所賀浪沖教授擔任主編。
我的好幫手
投訴建議:0571-87291296